"A molécula CO2 é apolar, sendo formada por ligações covalen Explicaê
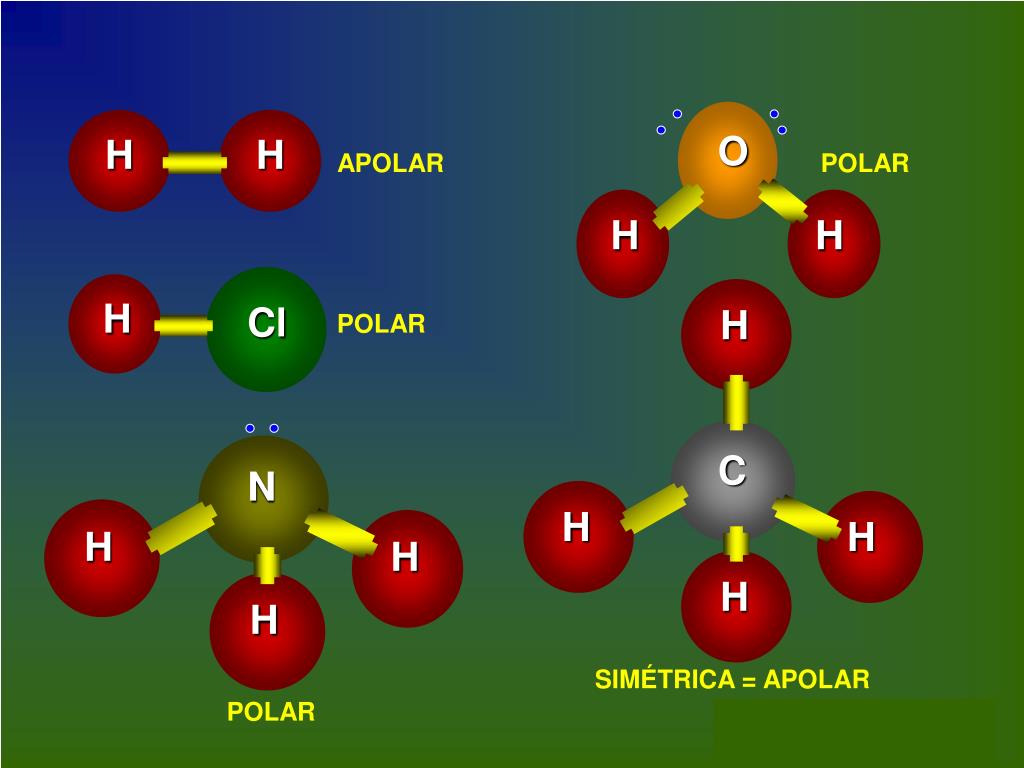
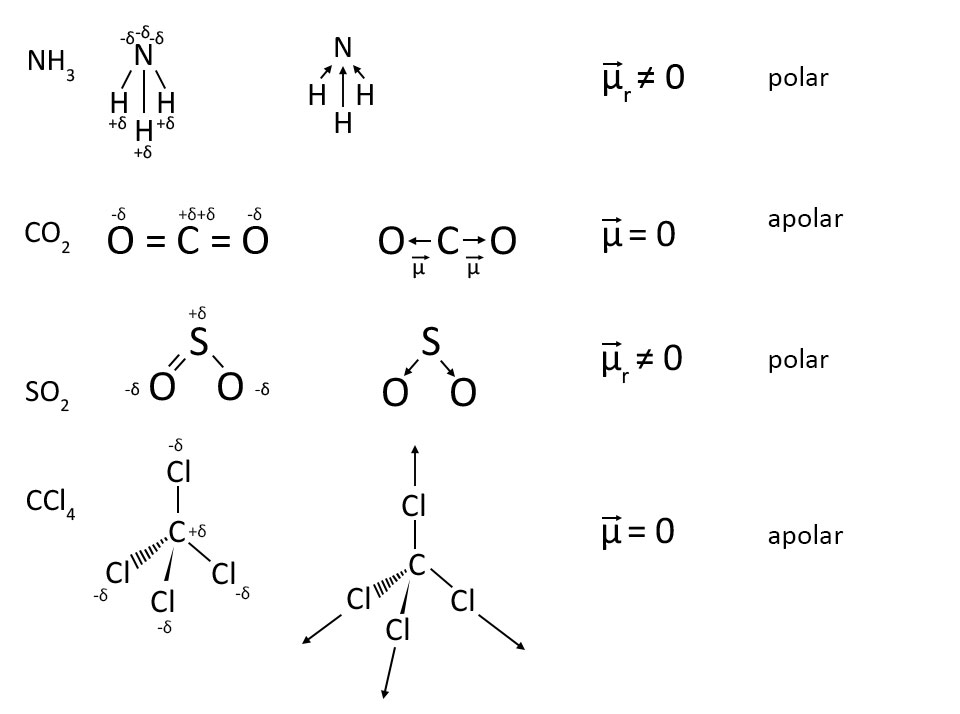
Moléculas polares. Quando uma molécula é formada por átomos diferentes há diferença de eletronegatividade, mas é a geometria da molécula que determina se a mesma será polar ou apolar.. Moléculas polares: H 2 O e NH 3. Nos dois exemplos, vemos que os átomos centrais, oxigênio e nitrogênio, possuem pares de elétrons desemparelhados que formam nuvens eletrônicas.
Polaridade das moléculas ( Cleber Julian ) PréSeed

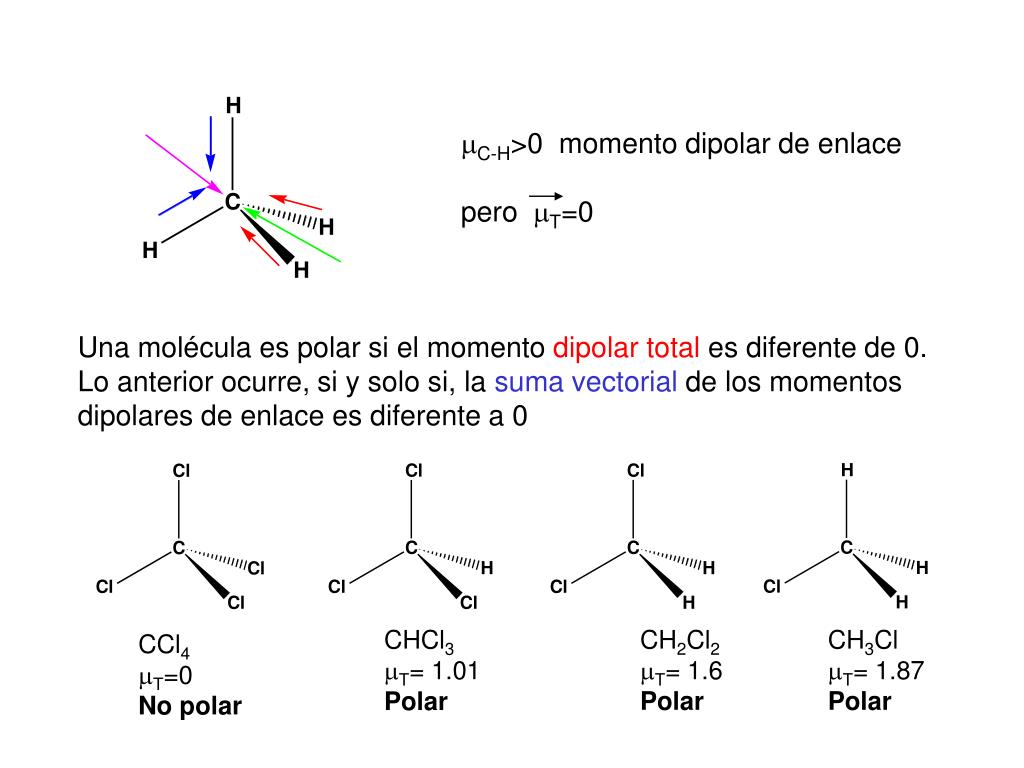
O cloreto de metileno ou diclorometano é moderadamente polar. Qualquer molécula pequena não pode ser polar ou apolar ao mesmo tempo * a polaridade é um intervalo. O cloro, sendo mais eletronegativo do que o hidrogênio, faz com que a molécula de diclorometano seja ligeiramente mais negativa do lado dos átomos de cloro.
classifique as ligações químicas das moléculas como polar ou apolar pronto. classifique também

Tetracloreto de carbono, também conhecido por outras designações (ver tabela), é um composto orgânico com a fórmula química CCl 4. É um reagente usado na química sintética e foi muito usado como agente extintor e como agente refrigerante. O tetracloreto de carbono é um líquido incolor com um cheiro adocicado e característico, que pode ser detectado a baixas concentrações.
Ch4 é Polar Ou Apolar

Diclorometano é um hidrocarboneto clorado, fórmula química CH2Cl2 , peso molecular 84,93 g/mol. É um líquido incolor e volátil. É amplamente utilizado como solvente, pois é considerado um dos compostos organoclorados menos perigosos, apesar de o seu limiar de aroma (214 ppm) indicar que já se ultrapassou o Valor Limite de Exposição.
Arranjos de Moleculas (polar e apolar) Arranjos de Moleculas (polar e apolar) Docsity
Então, conheça as substâncias orgânicas mais polares da química. Bom, saber quem é polar e apolar muito vezes é muito difícil para as pessoas. Por outro lado, existe a questão quem são os mais polares. Assim, lembrando de você que tem essa dificuldade estamos colocando aqui no Clube da Química um resumo para você.
Molécula Vectorial De Diclorometano En Varias Variantes Concepto De Química Orgánica Ilustración

São quatro pares, pois o carbono é tetravalente e o hidrogênio e o cloro são monovalentes. Dada a diferença de eletronegatividade entre os ligantes (Cl e H), a. na molecula do dicloro metano (CH2CL2), qual é o número de pares de eletrons que participam da ligações - brainly.com.br
PPT Momento dipolar Deducción de estructuras moleculares PowerPoint Presentation ID5982564
1,2-Dicloroetano, conhecido antigamente como dicloreto de etileno, abreviado como DCE, é um composto químico organoclorado importante como intermediário na produção do monômero cloreto de vinila, o principal precursor para a produção do polímero PVC. É um líquido incolor com um odor semelhante ao clorofórmio. 1,2-Dicloroetano é também usado geralmente como um intermediário para.
Co2e

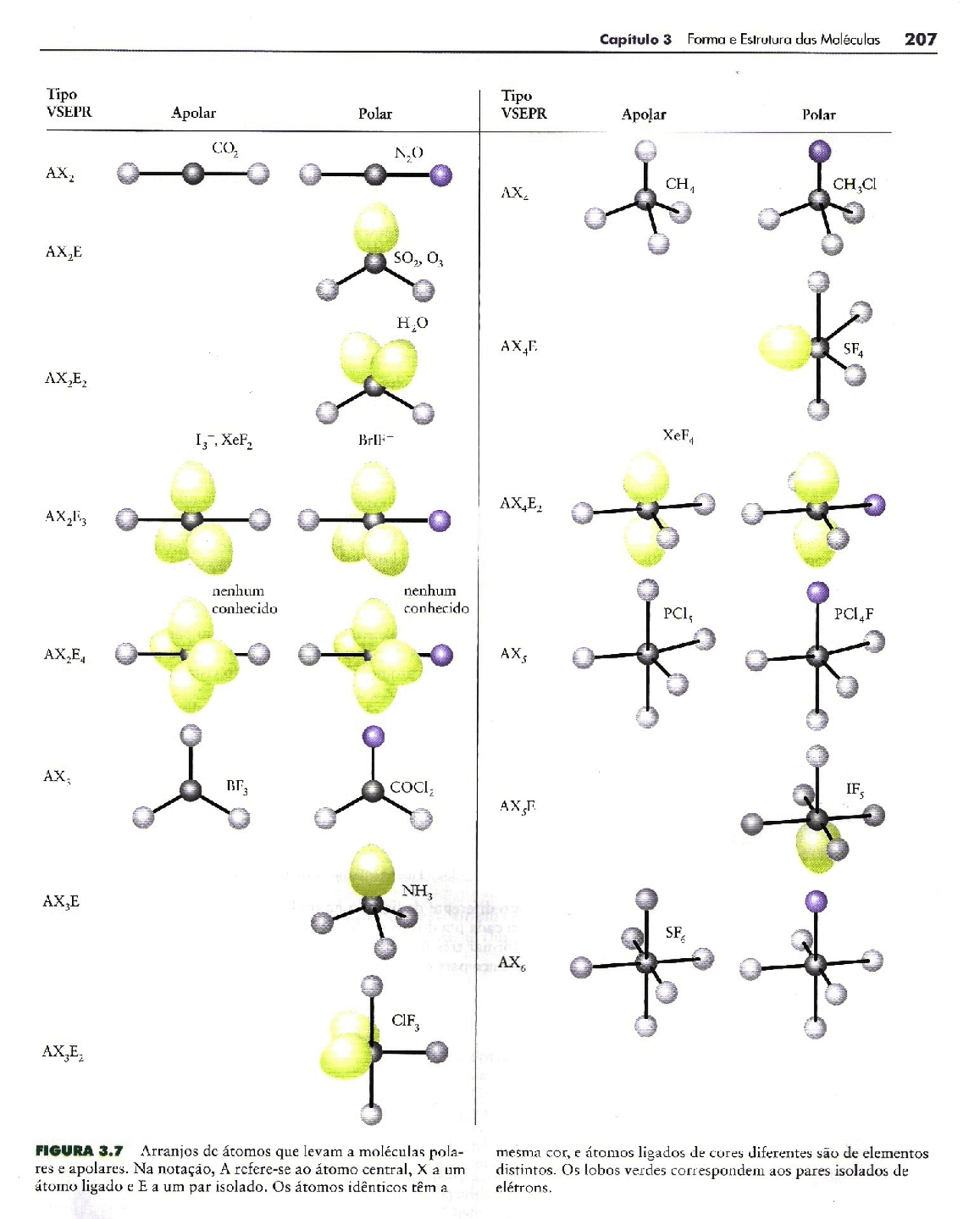
Mas as outras moléculas possuem três ou mais átomos e, nesses casos, podemos identificar a polaridade das moléculas de duas maneiras: 1ª) Analisando o vetor momento dipolar resultante (se der igual a zero é apolar, se der diferente de zero é polar); 2ª) Comparando o número de nuvens eletrônicas ao redor do átomo central com o número.
Forças de Van der Waals Conceito e características
A polaridade de uma molécula com mais de dois átomos é determinada pelo (vetor momento dipolar resultante), em que são somados os vetores de cada ligação polar da molécula. Quando o resultado é nulo, a molécula é apolar e, caso contrário, polar. Exemplo 1: Molécula de dióxido de carbono, CO 2. Elemento. Eletronegatividade. Carbono.
PPT Ligações Químicas PowerPoint Presentation, free download ID6059543
Série eluotrópica é uma lista de diversas substâncias ordenadas segundo seu poder de eluição para um determinado adsorvente.Tais séries são úteis para determinar os solventes necessários para o processo de cromatografia de uma mistura de substâncias.Normalmente as séries começam com os solventes não-polares, como o hexano e finalizam com os solventes polares, como a água ou metanol.
PPT ENLACE QUÍMICO PowerPoint Presentation, free download ID5238156

III. diclorometano CH 2 Cl 2. IV. triclorometano CHCl 3. V. tretraclorometano CCl 4.. apolar e polar. c) apolar, apolar e polar. d) polar, polar e apolar. e) polar, apolar e apolar. Ver resposta. Questão 4. Dadas as moléculas abaixo:. ou seja, formadas por cinco átomos, o que caracteriza um átomo ligado a outros quatro, em uma.
O que é e como ocorre a polaridade nas moléculas Clube da Química

Learn to determine if CH2Cl2 (Dichloromethane) is polar or non-polar based on the Lewis Structure and the molecular geometry (shape).We start with the Lewis.
Anglo Resolve
AA % = [(1- Abs.amostra )/ Abs.controle negativo] x 100. (1) Em que AA% é o percentual da atividade antioxidante, Abs.amostra é a absorbância do extrato ou farelo e Abs.controle negativo é a absorbância do controle negativo. Foi construída uma curva para cada extrato e farelo desengordurado, onde no eixo x tinha-se a concentração final.
Ligações Químicas
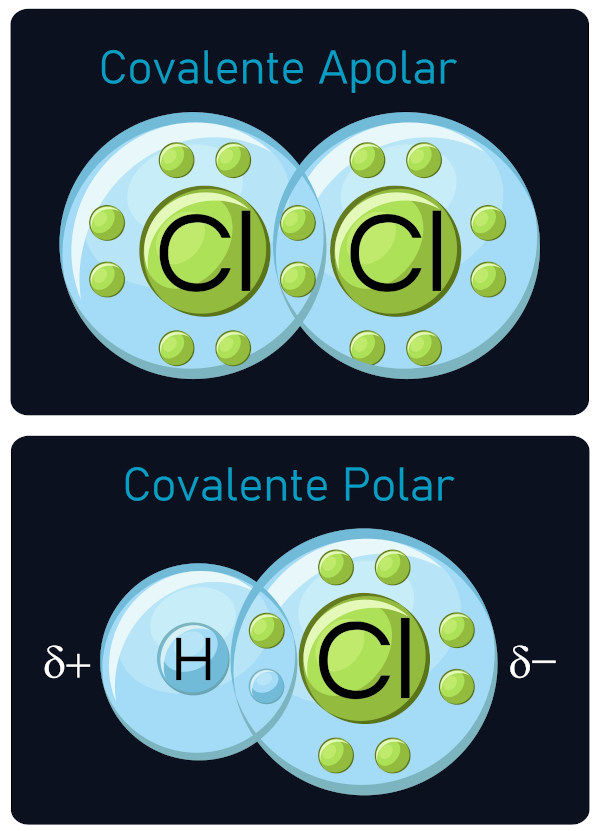
Se as moléculas de solvente forem polares, isto é, se o momento dipolar de cada molécula não for nulo, então o solvente denomina-se polar.Num solvente apolar, as moléculas de solvente possuem um momento dipolar nulo ou próximo de zero.. Quais são os solventes apolares. Solventes Apolares Nessa classe de solventes está o hexano, benzeno e clorofórmio.
Diferencia entre cloroformo y diclorometano.

Cloreto de etileno, também conhecido como Diclorometano (DCM), é um composto químico orgânico. CH2Cl2 é a fórmula química para DCM. É um líquido incolor e volátil com um odor doce. O composto é naturalmente derivado dos vulcões, zonas húmidas e outras fontes oceânicas. Tem muitos usos, mas é usado principalmente na indústria.
Como identificar se uma molécula é polar ou apolar? YouTube

A-. A polaridade das moléculas é um tópico importante no estudo da Química, pois nos ajuda a entender como as moléculas de uma ou mais substâncias interagem, o que pode determinar a solubilidade ou o ponto de fusão e ebulição dessas substâncias. A partir da análise da polaridade das moléculas, por exemplo, podemos explicar o fato de.
.